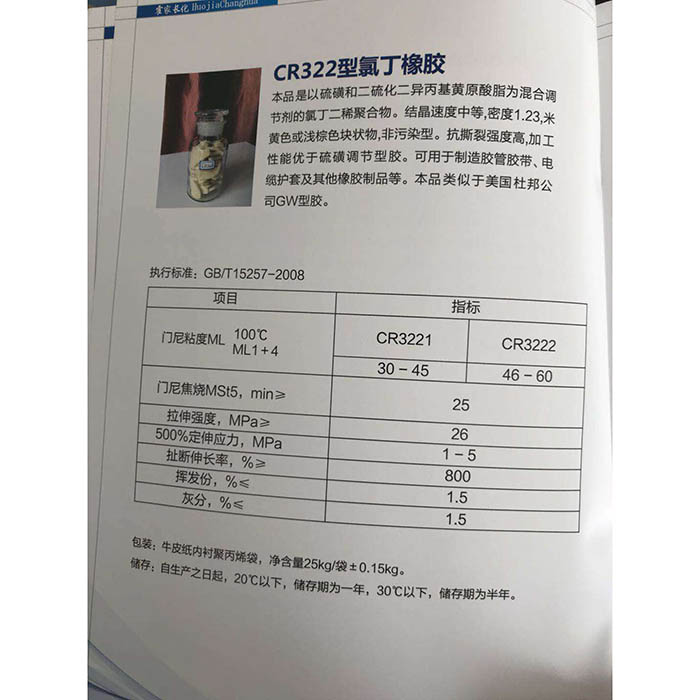
Hidróxido de sódio
Hidróxido de sódio, cuja fórmula química é NaOH, é comumente conhecida como soda cáustica, soda cáustica e soda cáustica. Quando dissolvido, ele emite cheiro de amônia. É um forte cáusticoalcalino, que geralmente está na forma de flocos ou granular. É facilmente solúvel em água (quando dissolvido em água, emite calor) e forma uma solução alcalina. Além disso, é deliquescente e absorve facilmente o vapor de água (deliquescência) e o dióxido de carbono (deterioração) no ar. O NaOH é um dos produtos químicos necessários em laboratórios químicos e também um dos produtos químicos comuns. O produto puro é um cristal incolor e transparente. Densidade 2,130 g / cm. Ponto de fusão 318,4 ℃. O ponto de ebulição é 1390 ℃. Os produtos industriais contêm uma pequena quantidade de cloreto de sódio e carbonato de sódio, que são cristais brancos e opacos. Existem blocos, escamosos, granulares e em forma de bastonete. Quantidade de tipo 40,01
Hidróxido de sódiopode ser usado como agente de limpeza alcalino no tratamento de água, que é dissolvido em etanol e glicerol; Insolúvel em propanol e éter. Ele também corrói carbono e sódio em alta temperatura. Reação de desproporção com halogênio, como cloro, bromo e iodo. Neutralize com ácidos para formar sal e água.
Propriedades físicas de dobramento
O hidróxido de sódio é um sólido cristalino translúcido branco. Sua solução aquosa tem sabor adstringente e sensação acetinada.
Deliquescência dobrável É deliquescente no ar.
Absorção de água dobrável
O álcali sólido é altamente higroscópico. Quando exposto ao ar, ele absorve moléculas de água no ar e, finalmente, se dissolve completamente em solução, mas o hidróxido de sódio líquido não tem higroscopicidade.
Solubilidade dobrável
Alcalinidade dobrável
O hidróxido de sódio se dissocia completamente em íons de sódio e íons de hidróxido quando dissolvido em água, por isso tem a generalidade de um álcali.
Ele pode realizar a reação de neutralização ácido-base com qualquer ácido protônico (que também pertence à reação de decomposição dupla):
NaOH + HCl = NaCl + H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + HNO3 = NaNO3 + H2O
Da mesma forma, sua solução pode sofrer dupla reação de decomposição com solução salina:
NaOH + NH3Cl = NaCl + NH2 · H2O
2NaOH + CuSO₄ = Cu (OH) ₂ ↓ + Na₂SO₄
2NaOH + MgCl₂ = 2NaCl + Mg (OH) ₂ ↓
Reação de saponificação de dobramento
Em muitas reações orgânicas, o hidróxido de sódio também desempenha um papel semelhante como catalisador, entre os quais o mais representativo é a saponificação:
RCOOR '+ NaOH = RCOONa + R'OH
Recolher outro
A razão pela qual o hidróxido de sódio se deteriora facilmente em carbonato de sódio (Na₂CO₃) no ar é porque o ar contém dióxido de carbono (co):
2NaOH + CO₂ = Na₂CO₃ + H₂O
Se o dióxido de carbono excessivo for continuamente introduzido, bicarbonato de sódio (NaHCO₃), comumente conhecido como bicarbonato de sódio, será gerado e a equação de reação é a seguinte:
Na₂CO₃ + CO₂ + H₂O = 2NaHCO₃
Da mesma forma, o hidróxido de sódio pode reagir com óxidos ácidos, como dióxido de silício (SiO₂) e dióxido de enxofre (SO):
2NaOH + SiO₂ = Na₂SiO₃ + H₂O
2 NaOH + SO (traço) = Na₂SO₃ + H₂O
NaOH + SO₂ (excessivo) = NaHSO₃ (NASO gerado e água reage com SO excessivo para gerar nahSO)